En el año 2009, la ICH (International Conference on Harmonization) propuso la Directiva ICH Q3D, con el objetivo de controlar y limitar la presencia de impurezas elementales o metales pesados potencialmente tóxicos en productos farmacéuticos.
La contaminación por metales en estos productos puede proceder de diferentes fuentes:
- Pueden provenir de las materias primas que se utilizan durante el proceso de síntesis.
- Catalizadores empelados en los procesos de producción de los mismos.
- Pueden aparecer como contaminantes por interacción con los equipos de procesado o con el material de acondicionado.
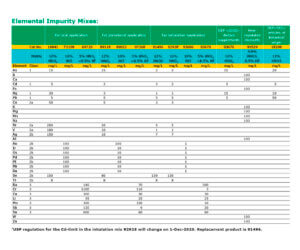
La Directiva ICH Q3D incluye un listado de 24 elementos agrupados en diversas categorías según su toxicidad y la probabilidad de ocurrencia de acuerdo con la dosis máxima admisible, para facilitar las decisiones a tomar durante los procesos de evaluación de riesgos.
En la metodología que se describe en la Directiva se encuentran los elementos que hay que considerar y sus límites, pero también la estrategia a seguir para la realización del análisis de riesgo y para su control en función de los valores límite.
En los diferentes laboratorios farmacéuticos el análisis de Metales de IQS dispone del uso ICP-MS (Espectrometría de Masas con Plasma Acoplado Inductivamente) o Absorción Atómica para la determinación de los mismos.
Continúe leyendo: Equipos Instrumentales Analíticos en la Industria Farmacéutica
Se tratan de técnicas de análisis capaces de determinar y cuantificar la mayoría de los elementos químicos, especialmente los metales, en muy bajas concentraciones.
La contaminación metálica en productos farmacéuticos puede ocasionar riesgos para la salud de los pacientes, debido a efectos toxicológicos, por tal razón sus niveles deben ser controlados durante todo el flujo de trabajo de producción de fármacos.
Desde el 1 de enero de 2018, USP y EP adoptaron el Directrices ICH Q3D para impurezas elementales y implementaron los límites en su capítulo general USP<232>, <233> y EP 9.3, capítulo general 5.20 y 2.4.20.
Los estándares o materiales de referencia certificados de Sigma – Aldrich presentan las siguientes características:
- Son mezclas de elementos certificados.
- Materiales de referencia con proporciones de elementos correspondientes a aplicaciones orales, parenterales e inhalatorias.
- Todas las concentraciones establecidas de acuerdo con los permitidos límites de exposición diarios (PDE) como se describe en el Guía ICH Q3D.
- Fabricados de acuerdo con ISO/IEC 17025 y ISO 17034.
- Los valores son trazables a al menos dos independientes referencias (NIST® o BAM).
- Fecha de caducidad.
- Información de almacenamiento.
- Cálculo adecuado de la incertidumbre.
- Presentación en botellas especiales fluoropoliméricas y herméticas a gases.
- Documentación completa según Guía ISO 31.
- Nivel insuperable de precisión y valor específico del lote.
- Conveniente tamaño de paquete de 100 ml.
Siguiendo las indicaciones de la Directiva ICH Q3D para controlar la calidad de las materias primas y de los productos acabados es también importante destacar la importancia de este tipo de análisis. Ofrecemos un amplio portafolio de estándares, reactivos, equipos, materiales e insumos para la industria farmacéutica.